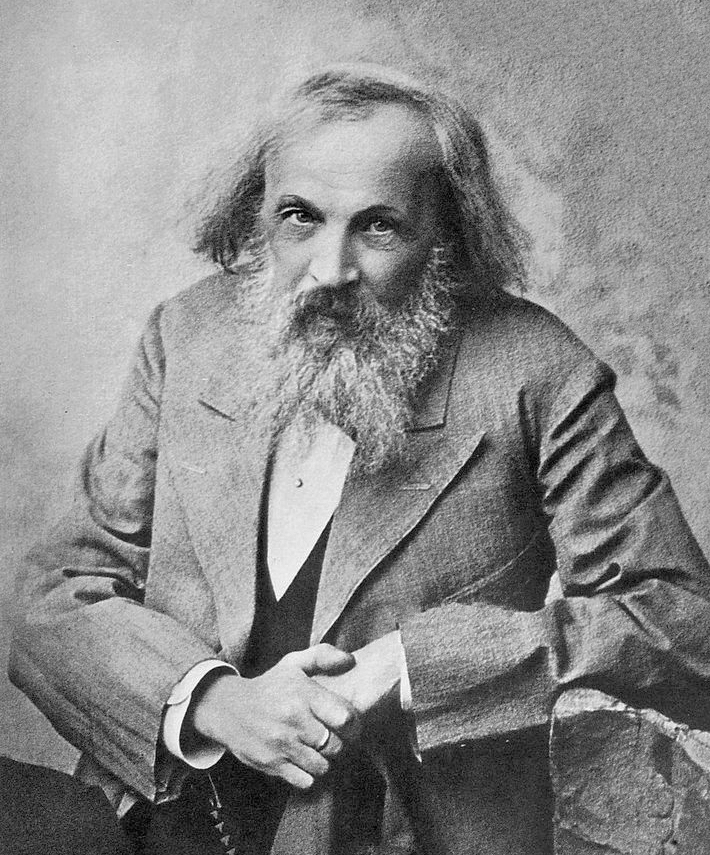Hola les damos la bienvenida a todos y todas a este blog para reforzar los conocimientos básicos para que aprendan más sobre la tabla periódica y sus diferentes autores y algunos datos que son de gran importancia
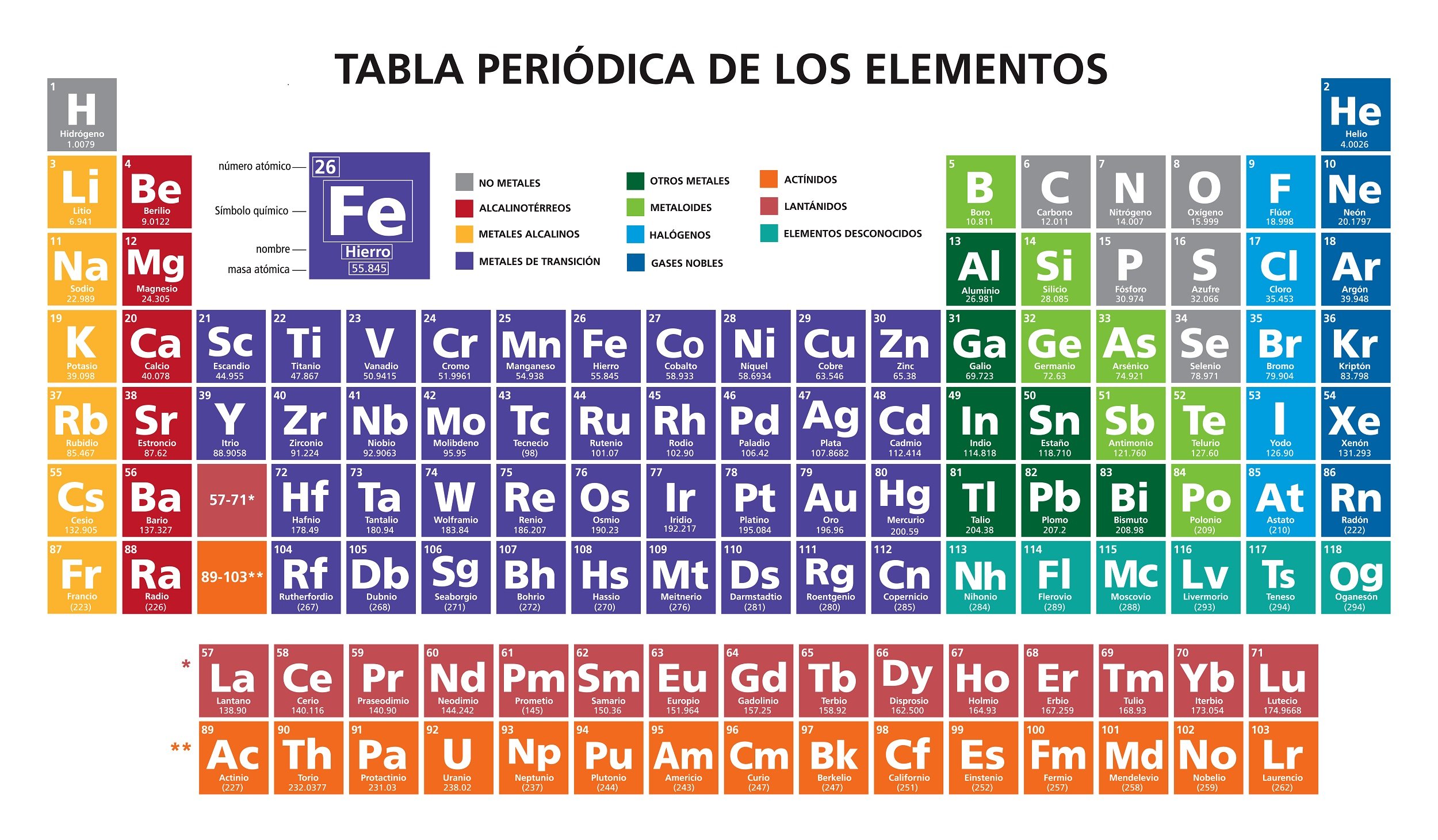
la tabla periódica
El número atómico indica el número total de protones del núcleo de un determinado átomo. Se representa con la letra Z y se coloca como subíndice
a la izquierda del símbolo del elemento.
Los átomos están compuestos por un núcleo (formado por
protones y neutrones) y por una corteza formada por electrones. Los
protones tienen carga positiva, los neutrones son eléctricamente neutros. Por
lo tanto el núcleo atómico siempre
tiene carga positiva. Por otro lado, los electrones tienen carga negativa.
¿Cuántos elementos químicos
hay?
La Unión internacional de Química pura y aplicada (IUPAC) admitió
oficialmente a comienzos de 2016 la existencia de 118 […
¿Que
significan las familias de la tabla periódica?
Las
18 columnas de la tabla periódica son llamadas grupos o familias, donde la
primera familia corresponde a los metales alcalinos y la última o 18
corresponde a los gases nobles; cada familia está determinada primordialmente
por el número de electrones - de valencia - de la última capa.
Los elementos incluidos en las 2 filas
separadas de la tabla y localizadas en la parte inferior pertenecen al grupo 3.
Las 7 filas que conforman la tabla periódica son los periodos que vienen dados
por las 7 capas o niveles de energía K, L, M, N, O, P, Q.
El
periodo que ocupa un elemento coincide con su última capa electrónica. Los
elementos situados en un mismo periodo tienen propiedades diferentes, pero
masas atómicas parecidas. En la tabla periódica podemos distinguir 4 bloques
generados de acuerdo al orbital que están ocupando los electrones más externos;
los orbitales son s, p, d y f que permite respectivamente hasta 2, 6, 10 y 14
electrones.
Al
bloque s pertenecen los elementos alcalinos y los alcalino térreos; el bloque p
está formado por los grupos que van del 13 al 18; el grupo f comprende las
familias que van de la 3 a la 12 y contiene a los metales de transición;
finalmente el bloque f que se posiciona en la parte inferior de los grupos,
contiene a las tierras raras
¿Autores
que modificaron la tabla periódica?
Entre
1817 y 1829, el químico alemán Johan Dobereiner clasificó a algunos elementos
en grupos de tres denominados triadas, ya que tenían propiedades químicas
similares. Por ejemplo, en la triada cloro (Cl), bromo (Br) y yodo (I) notó que
la masa atómica de Br estaba muy próxima al promedio de la masa de Cl e I.
Desafortunadamente no todos los elementos se agrupaban en triadas y sus
esfuerzos fallaron para proponer una clasificación de los elementos.
En
1863, el químico inglés, John Newlands clasificó los elementos establecidos en
varios grupos proponiendo la Ley de Octavas, conformado por elementos de masa
atómica creciente, donde ciertas propiedades se repetían cada 8 elementos.
En
1869, el químico ruso Dmitri Mendeleev publicó su primera tabla periódica de
los elementos organizada en orden creciente de masa atómica. Al mismo tiempo,
Lothar Meyer, químico alemán, publicó su tabla propia periódica con los
elementos ordenados de menor a mayor masa atómica. Mendeleev organizó su tabla
en filas horizontales dejando espacios vacíos donde debían incorporar algunos
elementos que aún no habían sido descubiertos. En esa organización Mendeleev
visualizó un patrón aparente: elementos con propiedades químicas similares
aparecen en intervalos regulares (o periódicos) en las columnas verticales de
la tabla. El respaldo a las predicciones de Mendeleev se produce tras el
descubrimiento de galio (Ga), escandio (Sc) y germanio (Ge) entre 1874 y 1885
localizándolos en aquellos espacios vacíos, lo que dio aun mas valor y
aceptación de su Tabla Periódica en la comunidad
En 1913, un químico inglés, Henry Moseley, mediante estudios de rayos X, determinó la carga nuclear (número atómico) de los elementos, reagrupándolos en orden creciente de número atómico, tal como la conocemos hoy.
¿Qué es la masa atómica?
En química se llama masa
atómica a la masa de un átomo, la cual se compone del total de la masa de
protones y neutrones.
Los gases nobles son un grupo de elementos químicos con propiedades muy
similares: por ejemplo, bajo condiciones normales, son gases monoatómicos inodoros, incoloros y
presentan una reactividad química muy baja. Se sitúan en
el grupo 18 (VIIIA) de la tabla periódica (anteriormente llamado
grupo 0).
Los siete gases son helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón (Xe), el
radiactivo radón (Rn) y el
sintético oganesón (Og).
Halógenos. Flúor (F), cloro (Cl), bromo (Br), yodo (I), astato (At) y teneso
(Ts).
Gases nobles. Helio (He), neón (Ne), argón (Ar), kriptón (Kr), xenón
(Xe), radón (Rn), oganesón (Og).
Otros no metales. Hidrógeno (H), carbono (C), azufre (S), selenio (Se),
nitrógeno (N), oxígeno (O) y fósforo (P)."
"Alcalinos. Litio (Li), sodio (Na), potasio (K), rubidio (Rb),
cesio (Cs), francio (Fr).
Alcalinotérreos. Berilio (Be), magnesio (Mg), calcio (Ca), estroncio
(Sr), bario (Ba) y radio (Ra).
Metales de transición. Escandio (Sc), titanio (Ti), vanadio (V), cromo
(Cr), manganeso (Mn), hierro (Fe), cobalto (Co), níquel (Ni), cobre (Cu), zinc
(Zn), itrio (Y), circonio (Zr), niobio (Nb), molibdeno (Mo), tecnecio (Tc),
rutenio (Ru), rodio (Rh), paladio (Pd), plata (Ag), cadmio (Cd), lutecio (Lu),
hafnio (Hf), tántalo (Ta), wolframio (W), renio (Re), osmio (Os), iridio (Ir),
platino (Pd), oro (Au), mercurio (Hg), lawrencio (Lr), rutherfordio (Rf),
dubnio (Db), seaborgio (Sg), bohrio (Bh), hasio (Hs), meitnerio (Mt),
darmstadio (Ds), roentgenio (Rg), copernicio (Cn).
Tierras raras. Lantano (La), cerio (Ce), praseodimio (Pr), neodimio
(Nd), prometio (Pm), samario (Sm), europio (Eu), gadolinio (Gd), terbio (Tb),
disprosio (Dy), holmio (Ho), erbio (Er), tulio (Tm), Iterbio (Yb), lutecio
(Lu).
Actínidos. Actinio (Ac), torio (Th), protactinio (Pa), uranio (U),
neptunio (Np), plutonio (Pu), americio (Am), curio (Cm), berkelio (Bk),
californio (Cf), einstenio (Es), fermio (Fm), mendelevio (Md), nobelio (No), lawrencio
(Lr).
Transactínidos. Rutherfordio (Rf), dubnio (Db), seaborgio (Sg), bohrio
(Bh), hassio (Hs), meitnerio (Mt), darmstadio (Ds), roentgenio (Rg), copernicio
(Cn), nihonio (Nh), flerovio (Fl), moscovio (Mc), livermorio (Lv), teneso
(Ts)."
para repasar